微生物技术国家重点实验室李盛英教授团队和张友明教授团队联合攻关,于2021年09月08日,在化学领域权威期刊《德国应用化学》 (Angewandte Chemie International Edition, IF: 15.336),发表了研究成果“Biosynthesis of chuangxinmycin featuring a deubiquitinase-like sulfurtransferase”。该研究揭晓了创新霉素生物合成中,历时50余年的硫原子引入的酶学机制谜底,被编辑部遴选为Very Important Paper(VIP),并受邀创作封面图片展示研究成果。
生命环境研究公共技术平台为该研究成果提供了重要仪器技术支撑。
该研究成果综合应用了四级杆飞行时间高分辨液质联用仪(图1A)、线性轨道阱电子转移解离裂解源高分辨液质联用仪(图2)、等温滴定量热仪(图3A)、圆二色谱仪(图4)等相关仪器技术:
一、四级杆飞行时间高分辨液质联用仪

图1A 四级杆飞行时间高分辨液质联用仪
为证实含硫抗生素去甲基创新霉素(图1B,化合物10)生物合成途径每步酶催化所产生的化合物中间体,该研究工作应用四级杆飞行时间高分辨液质联用仪HPLC-Q-TOF-HRMS (High Resolution Q-TOF Mass Spectrometry, Thermo Ultimate3000-Bruker ImpactHD) (图1A)检测了各种酶系合成的小分子化合物,包括一系列逐个体外酶反应体系及组合酶体系生成的小分子产物的定性定量检测,并最终建立了混合酶系“一锅反应法”,实现从源头化合物2到化合物10的转化(图1B,I)。
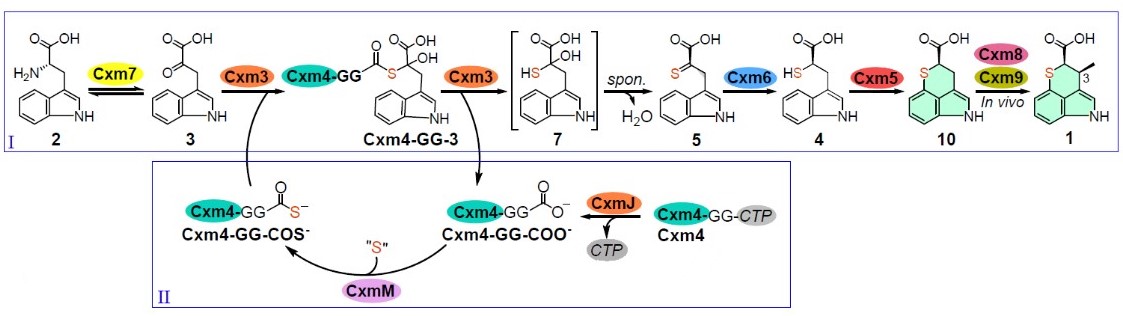
图1B “化合物2到化合物10”的合成转化
二、线性轨道阱电子转移解离裂解源高分辨液质联用仪

图2 线性轨道阱电子转移解离裂解源高分辨液质联用仪
为证实硫载体蛋白Cxm4转变成Cxm4GG-COS-活性形式的酶学过程,该研究工作应用线性轨道阱电子转移解离裂解源高分辨液质联用仪LTQ-Orbitrap velos pro ETD(High Resolution LTQ-Orbitrap mass spectrometer with ETD,Thermo) (图2)进行了完整蛋白分子量检测,检测结果经去卷积分析,验证了Cxm4每一步转变所需要的催化酶及Cxm4的中间体形式,直至Cxm4GG-COS-的形成,支撑了Cxm4GG-COS-的生物转化途径(图1B, Ⅱ)。
三、等温滴定量热仪
图3A 等温滴定量热仪
为证实硫转移过程中的蛋白-蛋白及蛋白-底物之间的相互作用,该研究应用等温滴定量热仪PEAQ-ITC (Isothermal Titration Calorimetry,MicroCal Malvern) (图3A)分析了硫转移酶Cxm3与Cxm4GG-COO-形式的硫载体蛋白,及Cxm3与硫受体分子及其类似物之间的相互作用,检测结果证实了“Cxm3与Cxm4GG-COO-形式的硫载体蛋白”及“Cxm3与硫受体分子类似物”间的相互作用均由焓变驱动,亲和力分别为7μM水平及2μM水平。揭示了“硫转移酶、硫供体蛋白、受体分子类似物在催化反应中心以硫转移酶为媒介形成可逆的非共价三元复合物”这一催化机制(图3B)。
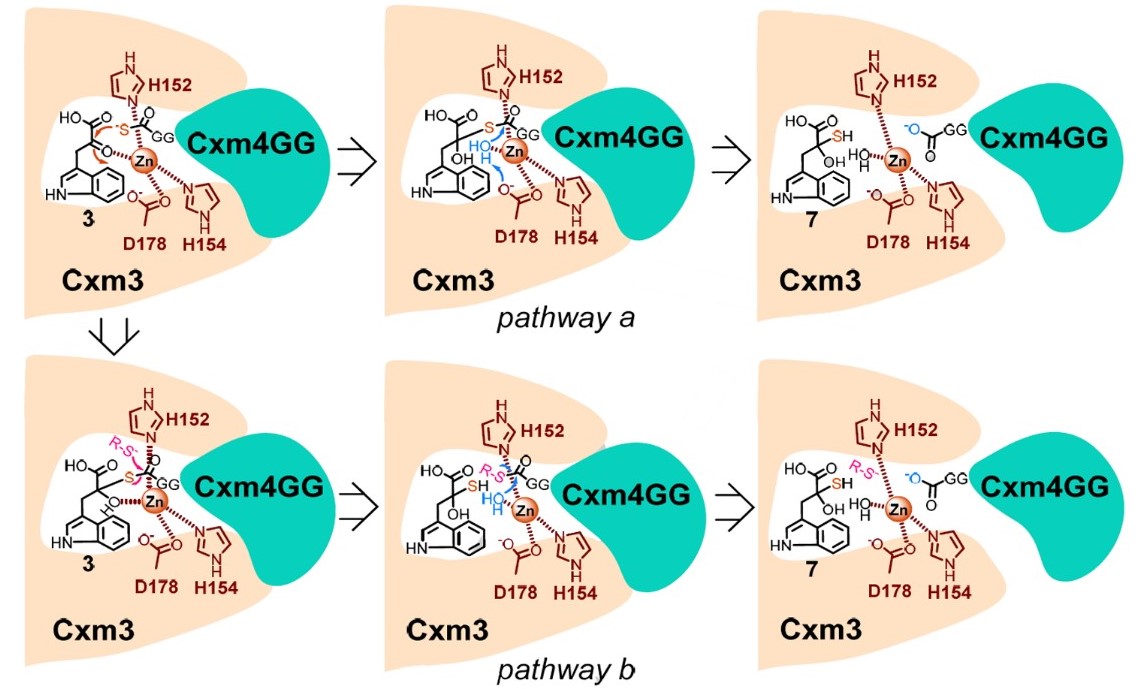
图3B 非共价三元复合物联合催化的新颖硫转移反应机理
四、圆二色谱仪

图4 圆二色谱仪
为证实催化位点附近的关键氨基酸替代突变对二级结构的影响,该研究工作应用圆二色谱仪(Circular Dichroism Spectrometer,JASCO) (图4)在180-290nm波长范围,相同条件下分别扫描了野生型和突变型蛋白的空间构象谱图,扣除缓冲液背景后,检测结果揭示突变型与野生型蛋白的空间构象未发生显著改变。结合突变体蛋白催化活性变化数据,揭示了Cxm3蛋白中对催化构象未造成显著影响但对催化硫转移活性至关重要的3个氨基酸位点H152、H154、D178(图3B)。
上述仪器位于青岛校区第周苑A座N1楼126和129室--生命环境研究公共技术平台蛋白质科学分平台,该分平台涵盖了从蛋白编码基因表达、蛋白质分离制备、蛋白质理化性质及相互作用、到蛋白质组学鉴定及后修饰、直至蛋白功能代谢产物分离鉴定的仪器技术支撑体系。
仪器使用预约入口http://www.yqpt.qd.sdu.edu.cn/lims/。
欢迎校内外用户前来预约测试!
注:文中图片来源于山东大学微生物技术国家重点实验室李盛英教授团队和张友明教授团队的多项研究成果。